1) 插入内镜
EBUS-TBNA应用的内镜提供视野角度为80°,视野方向为前方斜视35°。应当注意的是其提供的视野方向与普通支气管镜不同。此外,因超声探头坚硬,应当仔细操作内镜以防止探头损伤支气管壁。
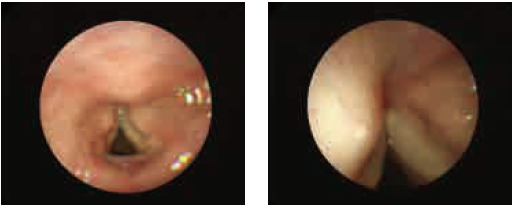
沿下表面按口腔弧线将内镜推进入咽穹窿。
⇩
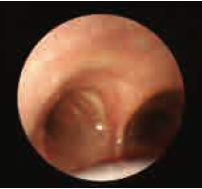
当到达咽穹窿后,在支气管镜屏幕上可见管腔。
(可通过轻微上抬下颌扩展空间)
⇩
将内镜插入气管时,密切观察声带上半部分以防止对
其造成损伤。
<图1>
2) 获得淋巴结图像
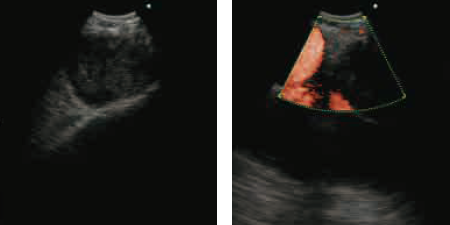
待将内镜插入气管后,适度膨胀水囊(通过注射约0.3mL无菌水)直至在内镜屏幕的右下方可见水囊。<图2>当考虑到在支气管腔内何处可获得目标病灶的图像时,将探头放置在气管/支气管表面,当观察到EBUS图像时尝试获得淋巴结的图像。缓慢向后/向前及左右移动内镜,微调图像直至获得淋巴结最大截面。
3) 确定穿刺位置
从支气管腔观察将探头放置在淋巴结区域处,确定内镜的操作方向以获得穿刺淋巴结的最大截面。必要时应用多普勒模式以检查穿刺部位与周围血管及淋巴结内血流的位置关系。
<图3>
● 穿刺部位与周围血管的位置关系:了解肺静脉、心脏及支气管动脉相对于穿刺淋巴结的位置方向。
● 确定淋巴结的穿刺部位:在B超中显示不均质声像且在多普勒模式中显示蜿蜒的血管的区域极有可能发生肿瘤转移。穿刺这些区域。一些报告指出在囊性病变及坏死性病变中进行的穿刺可导致严重感染。在进行穿刺前应考虑感染的潜在风险。
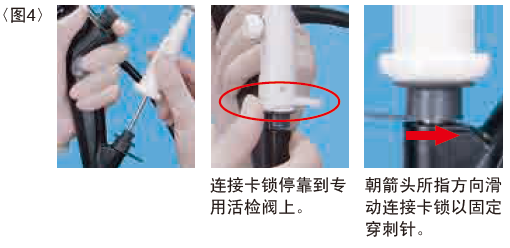
4) 连接吸引活检针
确保穿刺针安全状态并锁定。将吸引活检针插入内镜,将其连接至专用活检阀。当连接卡锁停靠到专用活检阀时,滑动连接卡锁以检查活检穿刺针是否安全固定在内镜上。<图4>
5) 进行穿刺
按照如下所示步骤进行穿刺:
① 固定鞘管的位置。 ② 决定穿刺路径。
③ 进行穿刺和针吸活检。 ④ 移除吸引活检针。
① 固定鞘管的位置
松开鞘管调节旋钮,向前推直至其在内镜图像中刚刚可见。
之后,降低支气管镜的角度。一旦在支气管镜图像中可见,推进鞘管远端直至穿刺部位,在EBUS图像中确定穿刺点。
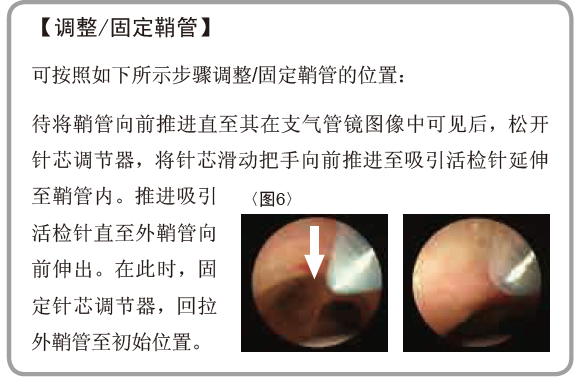
② 确定穿刺路径
确保穿刺软骨与软骨间韧带间的交界区<图 7>。因穿刺针将自EBUS图像中的蓝点处轻微斜向下进入<图8>,在评估穿刺路径时调整EBUS图像中淋巴结的位置(例如将淋巴结放置在中心略偏左处)。
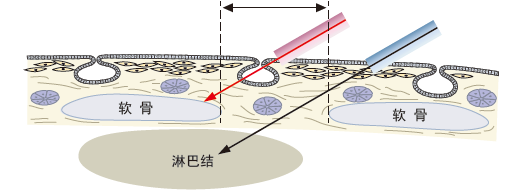

【确定穿刺路径】
也可按照以下步骤确定穿刺路径:
向后及向前(近侧-后侧)移动内镜。当鞘管的远端越过一个支气管软骨并在支气管软骨间卡住时,停止移动内镜。
检查内镜是否放置在软骨间,确认EBUS图像中的现象:当将鞘管远端放置在支气管软骨之间时,支气管软骨随内镜的前后移动而移动,在EBUS图像中淋巴结似乎与探头更加靠近
<图9>。
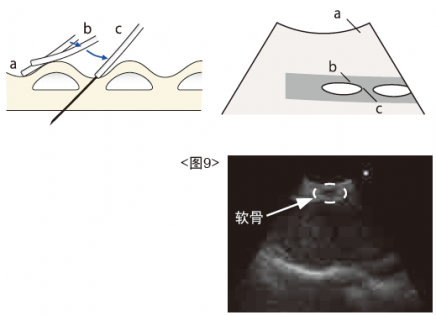
③ 进行穿刺及针吸活检
随着针芯调节器的释放,缓慢前推吸引活检针,检查EBUS图像并进行穿刺。
此处,由于穿刺针受到抵抗导致探头与支气管壁间的接触受到影响,EBUS图像有时模糊不清。助手应当推压以协助支气管镜的穿刺。
⇩
待进行穿刺后,调整内镜的角度从而能够在EBUS图像中清晰显示整个吸引活检针<图. 10>。
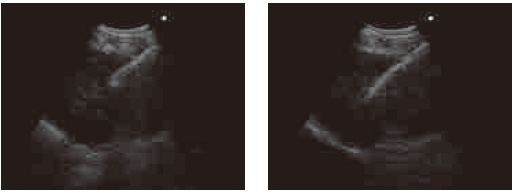
当操作者持活检针时,助手连接Vaclok注射器以施加负压。
⇩
当助手将内镜固定在患者(受试者)口部时,操作者边观察EBUS图像边通过吸引活检针的10-20次穿刺收集淋巴结内标本。
④ 回撤吸引活检针
活检针位于淋巴结内,移除Vaclok注射器,完全回撤吸引活检针直至其发出咔哒声。之后锁住针芯调节器
直至其完全退回在鞘管内,之后自内镜中回撤吸引活检针。
要点
● 吸引活检针的穿刺
吸引活检针在淋巴结中的穿刺部位距离应当为最长的可能距离:在坚硬的淋巴结中,缓慢插入,在柔软的淋巴结中,快速插入。插入穿刺针目的为切割病变以获得充足标本。如第一次穿刺未收集到标本,再次重复穿刺步骤可能更佳。
● 负压
虽然经常应用Vaclok注射器施加20mL的负压,在高血流的淋巴结穿刺中有时减至5-10mL以避免混入血液,其可导致诊断困难。
● 应当穿刺的淋巴结
适合穿刺的淋巴结为那些内部回声影像显示为非均质、高血流及血管走形紊乱的淋巴结。超声图像显示为低血流和分散的高回声部分很可能是坏死。自此处难以收集优质标本,此外,通常存在感染风险。
6) 处理标本
□ 中岛 崇裕教授的方法
① 应用探针推出“组织条”。将标本放置于滤纸上,在福尔马林中固定标本进行细胞学检查。
② 待推出组织条后,应用注射器将标本推出在载玻片上。按压以使标本在两个载玻片间铺开;一个应用湿法固定(在95%酒精中)→巴氏染色,另一个用于快速诊断(Diff-Quik染色)或Giemsa染色。
③ 用生理盐水中清洗穿刺针。应用清洗的标本进行微生
物培养及细胞学检查。
※ 在多伦多总院的一些病例中,将所有标本收集在酒精细胞固定液中
以用于细胞块诊断。
□ 藤原 大樹教授的方法
① 将探针插入吸引活检针中。将第一滴液滴放置在载玻片上以制备细胞学标本。
② 继续插入探针直至其到达远端以便将组织推至滤纸上。此处,应用滤纸吸收多余的血液,之后在福尔马林中将组织与滤纸固定在一起。
③ 回撤探针,应用气压将吸引活检针内残存的组织推至载玻片上以制备细胞学标本。
④ 应用生理盐水清洗吸引活检针针腔以制备细胞学检查和微生物培养标本。
□ 栗本 典昭教授的方法
① 再次将探针插入吸引活检针内,缓慢将组织推送至滤纸上形成组织条。之后在福尔马林中固定组织。
② 在收集组织后,应用注射器通过气压将残余的标本推出在载玻片上,迅速固定以进行细胞学检查。(否则标本变干,可能导致无法诊断)。
③ 应用生理盐水清洗穿刺针针腔,将溶液进行细胞学检查及细菌学检查。
□ 出云 雄大教授的方法
① 将探针插入吸引活检针中,将标本推送至载玻片上。
② 应用镊子拿起组织标本,放置在滤纸上,在福尔马林中固定。
③ 将另一载玻片放置在留在载玻片的标本上,按压将标本在两载玻片间铺开;一个应用湿法固定(在95%酒精中)→巴氏染色,另一个用于快速诊断(Diff-Quik染色)。应当注意的是过多用力将两载玻片进行摩擦将破坏细胞,导致观察困难。
④ 之后应用2-3mL生理盐水冲洗吸引活检针腔以制备液基细胞学检查及细菌培养标本。




- Content Type